Dispozitivele medicale, definiție și piață
Ce este un dispozitiv medical?
Legislația în vigoare definește dispozitivul medical ca fiind orice instrument, aparat, echipament, software, material sau alt articol, utilizate separat sau în combinație, inclusiv software-ul destinat de către producătorul acestuia a fi utilizat în mod specific pentru diagnosticare și/sau în scop terapeutic și necesar funcționării corespunzătoare a dispozitivului medical, destinat de către producător a fi folosit pentru om în scop de:
- diagnosticare, prevenire, monitorizare, tratament sau ameliorare a unei afecțiuni
- diagnosticare, monitorizare, tratament, ameliorare sau compensare a unei leziuni sau a unui handicap
- investigare, înlocuire sau modificare a anatomiei sau a unui proces fiziologic
- control al concepției
și care nu își îndeplinește acțiunea principală pentru care a fost destinat în organismul uman sau asupra acestuia prin mijloace farmacologice, imunologice sau metabolice, dar a cărei funcționare poate fi asistată astfel de mijloace.
Clasificare dispozitive medicale
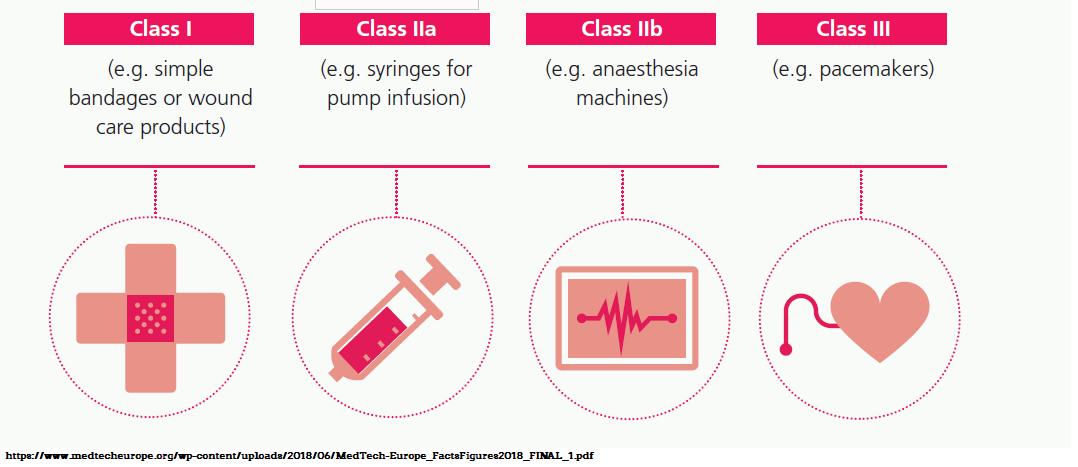
Dispozitivele medicale se clasifică conform Hotărârii nr.54/2009in patru clase de risc: I, IIa,IIb si III.
Clasa I este asociata cu risc scazut, iar clasa III cu riscul cel mai mare.
Producatorul de dispozitive clasa I este responsabil pentru evaluarea conformității în vederea aplicăriimarcajului de conformitate CE.Pentru dispozitivele medicale din clasele Is, Im, IIa, IIb si III producatorul trebuie sa se adreseze unui organism notificat pentru evaluarea conformitatii dispozitivului medical cu directiva de dispozitive medicale aplicabilă.
Piata globala a dispozitivelor medicale
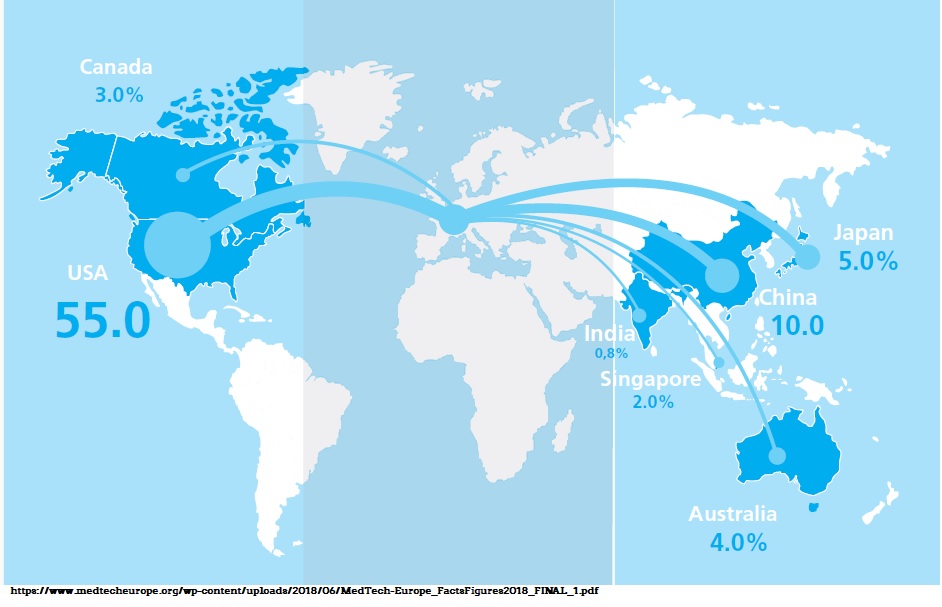
 Conform unui raport de specialitate, piața globală a dispozitivelor medicale este evaluată în prezent la 389 miliarde de dolari și se estimează că până în anul 2022 va ajunge la 483,8 miliarde de dolari. Principalii factori care genereză această creștere sunt îmbătrânirea populației, numărul în creștere al suferinzilor de boli cronice, creșterea cheltuielilor pentru sănătate, precum și dezvoltarea tehnologică continuă. Pentru a fi competitive și a răspunde cerințelor nevoii oamenilor de a fi sănătoși, companiile de dispozitive medicale investesc si dezvoltă periodic noi tehnologii, fie că este vorba de seringi, comprese, lentile de contact, dispozitive medicale pentru diagnosticare până la instrumente chirurgicale, scaune cu rotile sau echipamente medicale complexe.
Conform unui raport de specialitate, piața globală a dispozitivelor medicale este evaluată în prezent la 389 miliarde de dolari și se estimează că până în anul 2022 va ajunge la 483,8 miliarde de dolari. Principalii factori care genereză această creștere sunt îmbătrânirea populației, numărul în creștere al suferinzilor de boli cronice, creșterea cheltuielilor pentru sănătate, precum și dezvoltarea tehnologică continuă. Pentru a fi competitive și a răspunde cerințelor nevoii oamenilor de a fi sănătoși, companiile de dispozitive medicale investesc si dezvoltă periodic noi tehnologii, fie că este vorba de seringi, comprese, lentile de contact, dispozitive medicale pentru diagnosticare până la instrumente chirurgicale, scaune cu rotile sau echipamente medicale complexe.
La nivelul Uniunii Europene, peste 675.000 de oameni lucrează în industria dispozitivelor medicale în cele peste 27.000 companii din domeniu, dintre care peste 95% sunt întreprinderi mici și mijlocii și înregistrează vânzări totale de 110 miliarde de Euro.
În România, la nivelul anului 2017, piața dispozitivelor medicale era estimată la circa 500 milioane de Euro, împărțită fiind între cele aproximativ 300 de companii care se ocupă de producția, distribuția, importul și service-ul dispozitivelor medicale.
Cum sunt reglementate dispozitivele medicale ?
Între anii 1990-1998, la nivelul Uniunii Europene, la începutul anilor 1990 au fost adoptate directivele care reglementează dispozitivele medicale și care au fost transpuse în legislația națională de către statele membre, inclusiv de către România. Acestea sunt:
Directiva 90/385/CEE, dispozitive medicale implantabile active ( AIMDD)
Directiva93/42/CEE, dispozitive medicale (MDD)
Directiva 98/79/CE, dispozitive medicale pentru diagnostic in vitro (IVDMD)
Cu rolul de aplicării uniforme ale directivelor, a supravegherii și asigurării transparenței în domeniul dispozitivelor medicale, a asigurării rapide la informații a autorităților naționale, în baza acestor directive s-a constituit EUDAMED, baza de date europene privind dispozitivele medicale.

La nivel național, în România, Legea 95/2006 .Titlul XXstabilește cadrul legislativ și instituțional pentru controlul dispozitivelor medicale, tehnologiilor şi dispozitivelor asistive puse în funcţiune şi utilizate, precum şi pentru controlul activităţilor de comercializare, distribuţie şi de prestări de servicii în domeniul dispozitivelor medicale, tehnologiilor şi dispozitivelor asistive, Agenția Națională a medicamentului și a dispozitivelor medicale (ANMDM) fiind autoritatea competentă în domeniul dispozitivelor medicale.
Agenția Națională a medicamentului și a dispozitivelor medicale este instituția care avizează activitățile de comercializare și de prestări servicii, activitățile supuse avizării fiind următoarele: import dispozitive medicale, depozitare și distribuție dispozitive medicale, reparare, mentenanță și punere în funcțiune/instalare dispozitive medicale, optică medicală – montaj/reparare ochelari conform prescripției unui specialist, protezare.În vederea desfășurării acestor activități, solicitarea persoanelor fizice sau persoanelor juridice, în baza OMS nr. 1008/2016, a documentației solicitate și a inspecției specifice, ANMDM emite avizul de funcționare.
Producătorii sau reprezentanții autorizați ai acestora în teritoriu au obligația să se înregistreze la ANMDM când introduc pe piață următoarele tipuri de dispozitive medicale:
- dispozitive medicale din clasa I, inclusiv cele sterile și/sau cu funcție de măsurare;
- dispozitive medicale fabricate la comandă şi dispozitive medicale implantabile active fabricate la comandă;
- sisteme şi pachete de proceduri prevăzute la 29 din HG nr. 54/2009;
- dispozitive medicale pentru diagnostic în vitro;
De asemenea, în maxim trei luni de la punerea în funcțiune a unui dispozitiv medical pe teritoriul României, producătorul, reprezentantul autorizat al acestuia, importatorul sau distribuitorul, oricare dintre aceștia îl pune pe piață are obligația să notifice Agenția Națională a medicamentului și a dispozitivelor medicale. Această obligativitate este valabilă pentru următoarele tipuri de dispozitive :
- dispozitive medicale din clasele IIa, IIb şi III;
- dispozitive medicale pentru diagnostic in vitro care fac obiectul anexei nr. 2 la HG nr. 798/2003;
- dispozitive medicale pentru diagnostic in vitro de autotestare;
- dispozitive medicale implantabile active
Care sunt provocările pieții dispozitivelor medicale ?
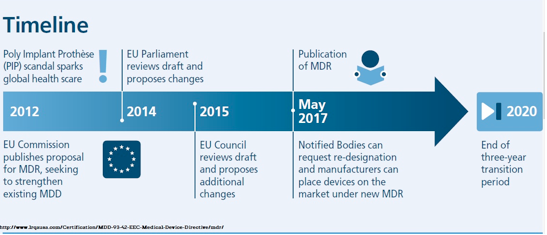 Piata dispozitivelor medicale se confruntă cu numeroase provocări la nivel național, european și internațional, ceea ce poate avea un impact asupra capacității de inovare, a competitivității globale și asupra rezultatelor financiare. O astfel de provocare o reprezintă revizuirea directivelor care guvernau dispozitivele medicale în Uniunea Europeană și apariția în 5 aprilie 2017 a Regulamentului Uniunii Europene 2017/745 privind dispozitivele medicale (MDR UE) și Regulamentul Uniunii Europene 2017/746 privind dispozitivele medicale pentru diagnostic în vitro, companiile având la dispoziție trei ani pentru a se conforma cerințelor acestuia, respectiv cinci ani pentru dispozitivele medicale pentru diagnostic în vitro.
Piata dispozitivelor medicale se confruntă cu numeroase provocări la nivel național, european și internațional, ceea ce poate avea un impact asupra capacității de inovare, a competitivității globale și asupra rezultatelor financiare. O astfel de provocare o reprezintă revizuirea directivelor care guvernau dispozitivele medicale în Uniunea Europeană și apariția în 5 aprilie 2017 a Regulamentului Uniunii Europene 2017/745 privind dispozitivele medicale (MDR UE) și Regulamentul Uniunii Europene 2017/746 privind dispozitivele medicale pentru diagnostic în vitro, companiile având la dispoziție trei ani pentru a se conforma cerințelor acestuia, respectiv cinci ani pentru dispozitivele medicale pentru diagnostic în vitro.
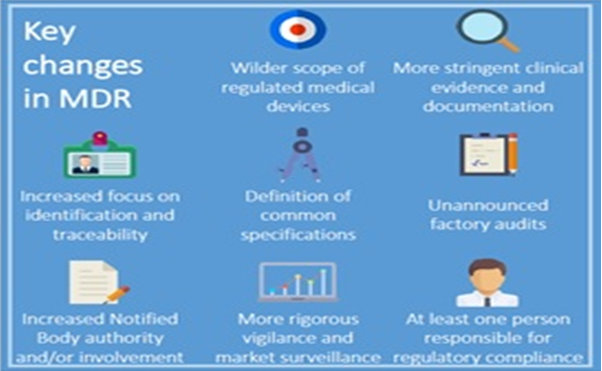
Noul regulament aduce o nouă perspectivă în segmentul dispozitivelor medicale, schimbările survenite fiind următoarele:
- Toate dispozitivele medicale vor trebui să facă obiectul unei evaluări independente a siguranței și a performanțelor înainte ca acestea să poată fi comercializate în Uniunea Europeană
- O mai mare transparență a informațiilor privind beneficiile pentru pacienți, riscurile reziduale și o evaluare aprofundată a acestora,raportul risc / beneficiu general va fi necesar
- Prezența în organizație a măcar unei Persoane Responsabile cu reglementările care să implementeze și să supervizeze un sistem de asigurare al calității privind dispozitivele medicale
- Se va implementa un nou sistem care să faciliteze trasabilitatea și transparența dispozitivelor medicale, și anume sistemul unic de identificare a dispozitivelor (UDI)
- Norme mai clare care să permită standardizarea
- Noile norme sprijină inovarea orientată spre pacient și țin cont în mod special de nevoile specifice ale multor întreprinderi mici și mijlocii din acest sector
- Organismele de notificare vor face obiectul unei examinări sporite din partea autorităților competente
Impactul acestei reglementări va duce la modificări în dinamica producătorilor de dispozitive medicale și portofoliilor lor existente, precum și viitoare. Noile reglementări abordeaza deficiențele legislației actuale și vizează creșterea încrederii globale pe piața dispozitivelor medicale.Costurile de conformare vor fi,cel mai probabil crescute, însă, este important ca firmele de dispozitive medicale să se pregătească proactiv pentru aceste schimbări, deoarece impactul acestora va fi semnificativ, fiind totodată o oportunitate de a aduce valoare adăugata companiei.
Sursa foto aici
###
Vă mulțumim pentru interesul aratat! Dacă ați găsit acest articol util, interesant sau inspirațional, vă invit să ne lăsați comentariile voastre mai jos sau aici.
Pentru alte articole și pastile de inspirație urmariti-ne pe site sau pe pagina noastră de Facebook.